Riziká nerovnováhy kyslíka v tele
Nobelovka za medicínu 2019
Priveľa a primálo kyslíka v organizme
Kyslík je nevyhnutný pre ľudský život. Využíva sa pri dýchaní ako súčasť procesu, ktorý premieňa jedlo na energiu, aby umožnil metabolizmus a tým udržal život. Ale s kyslíkom musíme v tele zaobchádzať rozumne; priveľa kyslíka (môže sa vyskytnúť v hyperbarickom prostredí alebo pri 100 % dýchaní na klinické účely) je toxické, ale aj príliš málo kyslíka (môže sa vyskytnúť pri chorobných stavoch, traumách alebo vo vyššej nadmorskej výške) má za následok smrť. Telo sa môže v rozumnom prípade prispôsobiť nižšiemu čiastkovému tlaku kyslíka, ktorý sa vyskytuje bežne: takáto adaptácia je rozhodujúca pre fyziologickú funkciu organizmu vo vššej nadmorskej výške a pri niektorých chorobných stavoch.
Proteínový komplex, ktorý sa viaže na identifikovaný segment DNA kyslíkovo závislým spôsobom, je faktor indukujúci (vytvárajúci) hypoxiu (HIF). HIF pozostáva z dvoch rôznych proteínov, viažucich DNA, takzvané transkripčné faktory - HIF-1a a ARNT.
Keď sú hladiny kyslíka vysoké, bunky obsahujú veľmi málo HIF-1a. Avšak, keď sú hladiny kyslíka nízke, množstvo HIF-1a sa zvyšuje, takže sa môže viazať na gén EPO, a tak regulovať gén EPO (erytropoetín), ako aj ďalšie gény so segmentmi DNA, viažucimi HIF. HIF-1a, ktorý je normálne rýchlo degradovaný, je chránený pred degradáciou pri hypoxii. Pri normálnej hladine kyslíka degraduje HIF-1a bunkový stroj nazývaný proteazóm. Za týchto podmienok sa malý peptid ubikvitín pridá k proteínu HIF-1a. Ubikvitín funguje ako značka proteínov určených na degradáciu v proteazóme.
Erytropoetín (EPO) je hormón, ktorý vzniká hlavne v obličkách, malé množstvo aj v pečeni. Je to primárny regulátor erytropoézy, ktorý stimuluje proliferáciu a diferenciáciu prekurzorových erytroidných buniek v kostnej dreni. Jeho vylučovanie je regulačne viazané na tlak a nadmorskú výšku.
Gén VHL kóduje proteín, ktorý zabraňuje vzniku rakoviny. Rakovinové bunky bez funkčného génu VHL exprimujú (vytláčajú) abnormálne vysoké hladiny génov regulovaných hypoxiou; ale keď sa gén VHL znova zavedie do rakovinových buniek, obnovia sa normálne hladiny. Toto dôležité vodítko ukazuje, že VHL sa podieľala na kontrole reakcií na hypoxiu. Ukazuje sa, že VHL je súčasťou komplexu, ktorý značí proteíny ubikvitínom a značí ich degradáciu v proteazóme. VHL môže fyzicky interagovať (vzájomne pôsobiť) s HIF-1a a je potrebný na jeho degradáciu pri normálnej hladine kyslíka. Toto presvedčivo spája VHL s HIF-1a.
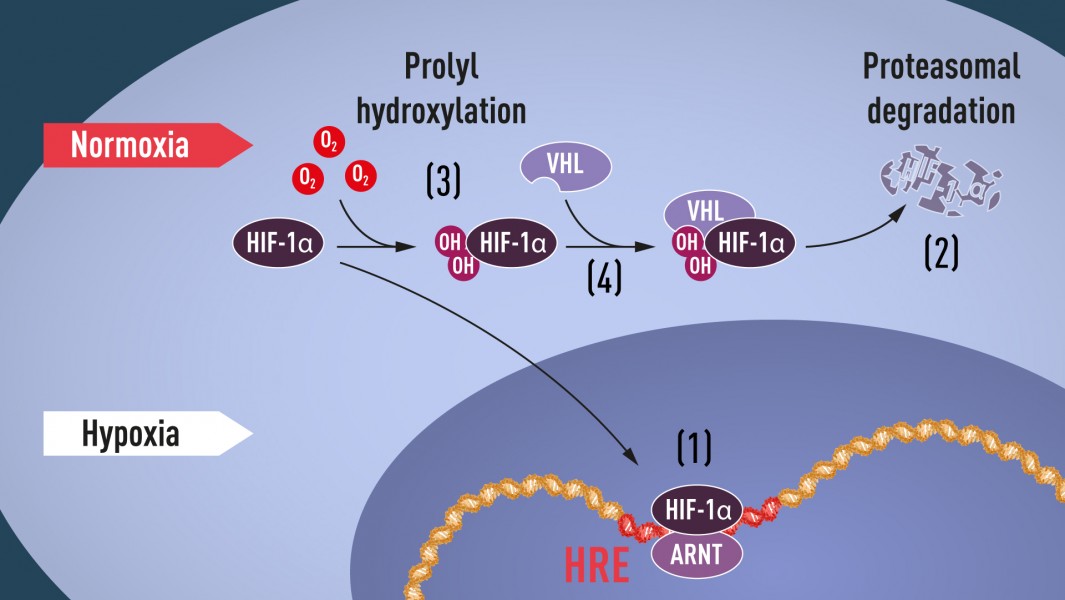 Ak je hladina kyslíka nízka (hypoxia), HIF-1a je chránený pred degradáciou a hromadí sa v jadre, kde sa spája s ARNT a viaže sa na špecifické sekvencie DNA (HRE) v génoch regulovaných hypoxiou (1). Pri normálnej hladine kyslíka je HIF-1a rýchlo proteazómom degradovaný (2). Kyslík reguluje proces degradácie pridaním hydroxylových skupín (OH) k HIF-1a (3). Proteín VHL potom môže rozoznať a tvoriť komplex s HIF-1a, čo vedie k jeho degradácii kyslíkom závislým spôsobom (4).
Ak je hladina kyslíka nízka (hypoxia), HIF-1a je chránený pred degradáciou a hromadí sa v jadre, kde sa spája s ARNT a viaže sa na špecifické sekvencie DNA (HRE) v génoch regulovaných hypoxiou (1). Pri normálnej hladine kyslíka je HIF-1a rýchlo proteazómom degradovaný (2). Kyslík reguluje proces degradácie pridaním hydroxylových skupín (OH) k HIF-1a (3). Proteín VHL potom môže rozoznať a tvoriť komplex s HIF-1a, čo vedie k jeho degradácii kyslíkom závislým spôsobom (4).
V bunkách bol objavený enzým (prolylhydroxyláza), ktorý je aktivovaný kyslíkom (je to ko-substrát). Pri normálnych hladinách kyslíka enzým ničí transkripčný (prepísaný) faktor vytváraný hypoxiou (nízky obsah kyslíka), alebo HIF-1, ktorý bunky neustále tvoria. Keď hladina kyslíka v bunke klesá - hypoxia, enzým neničí HIF-1 tak dobre a bunky menia aktivitu na zlepšenie dodávania kyslíka, napríklad tým, že vytvárajú viac červených krviniek a nové krvné cievy.
Kľúčovou fyziologickou odpoveďou na hypoxiu je zvýšenie hladiny hormónu erytropoetín (EPO), čo vedie k zvýšenej tvorbe červených krviniek (erytropoéza).
Pri normálnych hladinách kyslíka sa hydroxylové skupiny pridávajú v dvoch špecifických polohách v HIF-1a. Táto proteínová modifikácia, nazývaná prolylhydroxyláza, umožňuje VHL rozpoznať a viazať sa na HIF-1a, a tak normálne hladiny kyslíka regulujú rýchlu degradáciu HIF-1a pomocou enzýmov citlivých na kyslík (tzv. prolylhydroxyláza). Funkcia aktivácie génov HIF-1a je regulovaná hydroxyláciou závislou od kyslíka.
 Udelený mechanizmus snímania kyslíka má vo fyziológii zásadný význam, napríklad pre náš metabolizmus, imunitnú reakciu a schopnosť prispôsobiť sa cvičeniu. Ovplyvňuje aj množstvo patologických procesov. Intenzívne úsilie sa vyvíja vo vývoji nových liekov, ktoré môžu buď inhibovať alebo aktivovať kyslíkovo regulované zariadenie na liečbu anémie, rakoviny a iných chorôb.
Udelený mechanizmus snímania kyslíka má vo fyziológii zásadný význam, napríklad pre náš metabolizmus, imunitnú reakciu a schopnosť prispôsobiť sa cvičeniu. Ovplyvňuje aj množstvo patologických procesov. Intenzívne úsilie sa vyvíja vo vývoji nových liekov, ktoré môžu buď inhibovať alebo aktivovať kyslíkovo regulované zariadenie na liečbu anémie, rakoviny a iných chorôb.
Ako príklad sa poskytuje mechanizmus, ktorým sa reguluje počet červených krviniek, ktoré nesú kyslík v krvi, aby zodpovedal požiadavkám tkanív na kyslík s jeho dostupnosťou. To je dôvod, prečo niektorí športovci trénujú vo vyššej nadmorskej výške - nízka hladina kyslíka stimuluje nárast červených krviniek, čo im dáva výhodu na hladine mora na zlepšenie dodávky kyslíka do svalov počas namáhavého cvičenia alebo vrcholného výkonu.
HIF je kritická cesta pre rast určitých nádorov, kde sú hladiny kyslíka v nádore nízke, pre vývoj nových krvných ciev v zle perfundovaných (premývaných) tkanivách a pri škodlivých zmenách v pľúcach u ľudí s chronickým hypoxickým ochorením pľúc.
Rôzne úrovne kyslíka regulujú základné fyziologické procesy. Senzor kyslíka umožňuje bunkám prispôsobiť ich metabolizmus nízkym hladinám kyslíka: napríklad v našich svaloch počas intenzívneho cvičenia. Medzi ďalšie príklady adaptačných procesov kontrolovaných pomocou kyslíka patrí tvorba nových krvných ciev a tvorba červených krviniek. Náš imunitný systém a mnoho ďalších fyziologických funkcií organizmu je vyladených na O2-snímanie ústrojenstiev ((orgány vykonávajúce určité funkcie - pohybové, nervové, zmyslové). Senzorizácia kyslíka sa dokonca ukázala ako nevyhnutná počas vývoja plodu na kontrolu normálnej tvorby krvných ciev a vývoja placenty.
Keď sú hladiny kyslíka normálne, proteín VHL pomáha označkovať bunkový proteín HIF na zničenie. Keď hladina kyslíka klesne, HIF pretrváva, takže môže obnoviť zdravý prísun kyslíka podporovaním rastu krvných ciev a stimuláciou tvorby erytropoetínu. Ale ako vie VHL, že kyslíka je nedostatok a mal by HIF ponechávať samotný?
Keď je prítomný kyslík, HIF získa hydroxylovú skupinu (-OH). Ak v tejto skupine nie je dostatok kyslíka na zabezpečenie atómu kyslíka, HIF nie je hydroxylovaný. Navyše dostupnosť kyslíka určuje účinnosť hydroxylačného enzýmu. Takže HIF zostáva nezmenený, keď je nedostatok kyslíka, pričom uniká tým, že je označkovaný VHL (pretože hydroxylová skupina slúži ako väzobný signál) a prežije, aby inicioval rast krvných ciev.
To viedlo k vývoju nových liekov na báze toho, ako telo vníma kyslík. Pre ľudí s anémiou alebo nízkym počtom červených krviniek môžu byť tieto lieky kritické. Nabádajú telo, aby si myslelo, že je na vrchole Mount Everestu - kde je nedostatok kyslíka, čo spôsobuje produkciu ďalších červených krviniek.
Bunky organizmu využívajú mechanizmus adaptácie na nedostatok kyslíka. Keď dávku kyslíka zvýšime príliš rýchlo, bunky zabijeme.